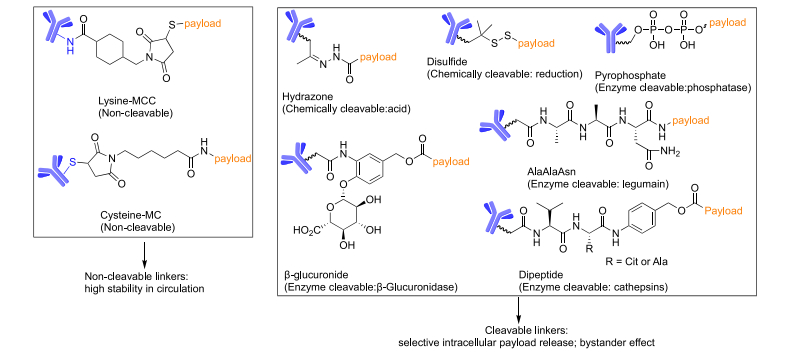
ADC连接子分为可切割型与不可切割型两类。根据切割机制,可切割型连接子又可细分为化学切割型与酶切型(图 3)。连接子的长度、极性与稳定性对ADC的治疗效果至关重要。连接子的设计通常取决于ADC的用途及作用方式。已有多篇综述总结了不同类型的连接子,因此当前部分主要聚焦于肽连接子,即一类重要的酶切型连接子。作者概述了组织蛋白酶可切割的二肽、三肽与四肽连接子,并重点介绍利用其他酶类作为释放机制的肽连接子开发进展,以及通过连接子修饰提升ADC治疗效果的策略。
高效ADC需要在循环中保持载荷−连接子复合物的稳定性,同时在肿瘤细胞内高效释放药物。ADCs通常被转运至肿瘤细胞溶酶体,在此高浓度的水解酶或蛋白酶选择性切割肽连接子,释放载荷。早期的研究主要集中于蒽环类前药,如将阿糖胞苷(DNR)或阿霉素(DOX)与二肽偶联。Ala−Leu−DNR在肿瘤细胞内被激活并水解为DNR。为提升稳定性与切割效率,研究者设计了自裂解型对氨基苄基氨基甲酸酯(PABC)间隔子,并证实其对蛋白酶激活前药设计至关重要。若缺乏PABC间隔子,cathepsin B无法切割前药并释放DOX,ADC也随之失效。
Cathepsin B是一种溶酶体蛋白酶,属于木瓜蛋白酶家族,在大多数肿瘤中过度表达,其活性受限于酸性环境(pH3.5−6.0),而在正常细胞外环境几乎不表达,仅在病理条件(如转移瘤)下出现。因此,基于cathepsin B可切割的肽连接子通常在循环中保持稳定。研究表明,含Phe−Lys−PABC−DOX或Val−Lys−PABC−DOX的前药可被cathepsin B高效切割,释放自由DOX,并在血浆中保持稳定。Arg虽被测试作为替代氨基酸,但表现不如Lys;而与Arg同构的瓜氨酸(Cit)在Val−Cit−PABC−DOX中则展现出良好的血浆稳定性。不同肽基对DOX释放速率存在差异,例如Z-Phe−Lys−PABC−DOX的释放速率比Z-Val−Cit−PABC−DOX快30倍,但在大鼠肝溶酶体中两者速率相同。比较来看,Val−Cit连接子在血浆稳定性优于Phe−Lys连接子,两者均显示出显著抗肿瘤活性。
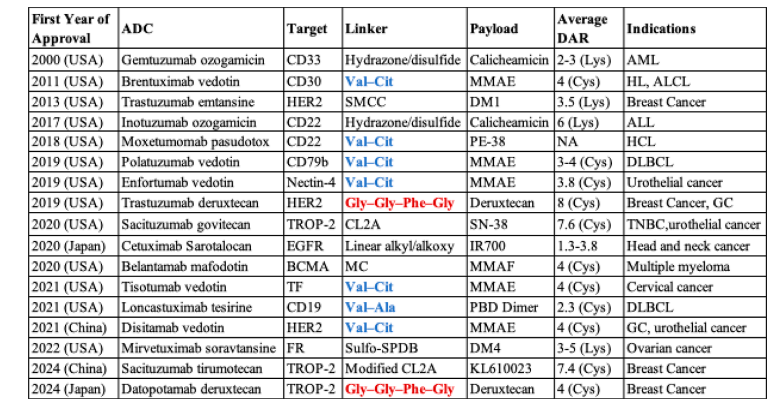
目前,Val−Cit连接子是研究最为广泛的溶酶体可切割二肽连接子,已用于6种FDA批准药物中。另一类Val−Ala连接子也被证实为有效的蛋白酶可切割基团,并已用于批准药物loncastuximab tesirine (表 2)。在cathepsin B体外实验中,Val−Ala的切割速率约为Val−Cit的一半,但其疏水性较低,且具有更高的药物−抗体比(DAR),并能减少ADC聚集。进一步比较显示,带有Val−Ala连接子的ADC抗肿瘤活性优于Val−Cit、Val−Lys与Val−Arg类似物。近期,Val−Gln连接子在细胞裂解液与cathepsin中切割速度更快,且含有Val−Gln的ADC展现出强效抗肿瘤活性(表 2)。这些结果均表明,酶切型肽连接子是ADC药物中的关键组成。
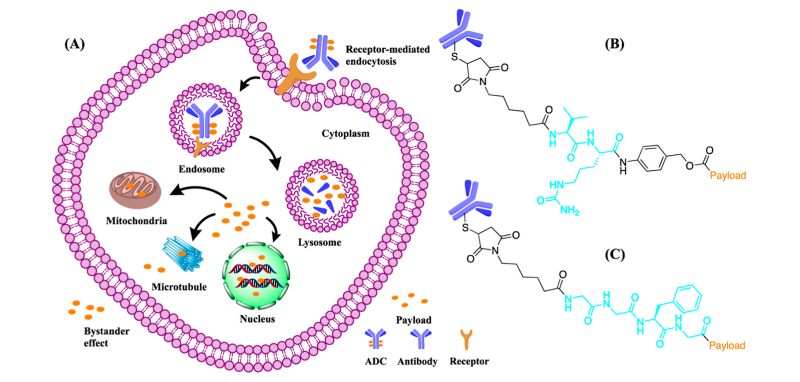
图2 (A) 传统ADC作用机制:ADC的抗体与癌细胞表面受体结合,形成ADC−抗原复合物,并通过受体介导的内吞作用进入细胞。随后,ADC从内体转运至溶酶体,在此降解释放载荷至细胞质中。游离载荷通过与微管、线粒体或细胞核内DNA相互作用来杀伤肿瘤细胞。一部分载荷还可扩散至邻近肿瘤细胞,产生旁观者效应。(B) Val−Cit二肽连接子的化学结构。(C) Gly−Gly−Phe−Gly四肽连接子的化学结构,均以青色标注。
尽管Val−Cit或Val−Ala二肽连接子在人体血浆中稳定,且能在靶细胞溶酶体中高效释放药物,但仍存在一些局限:
虽然通过降低DAR可缓解疏水性带来的负面影响,但对于低表达靶点或中等效力载荷而言,该方法并不适用。鉴于Val−Cit与Val−Ala连接子的局限性,研究者已开发出多种新型cathepsin可切割肽连接子来克服这些问题(表 2)。
表1 | 全球已上市的ADC及其特征
带有Glu−Val−Cit连接子的ADC表现出良好的酶切药物释放效果,并且在小鼠体内几乎不发生过早切割。另一种采用喜树碱衍生物作为载荷、通过新型亲水性cathepsin可切割的Val−Lys−Gly三肽连接子偶联的ADC,在实体瘤与血液肿瘤的临床前研究中均展现出广谱治疗活性。Glu−Gly−Cit连接子在小鼠和灵长类模型中保持长期稳定性,并能抵抗中性粒细胞蛋白酶介导的降解,含有该连接子的ADC在乳腺癌治疗中表现出更佳的疗效与安全性。使用Val−Ala−Gly三肽连接子的ADC抗肿瘤活性优于已批准的Kadcyla。该连接子虽不含PABC自裂解基团,但能在靶细胞溶酶体内切割释放药物。
Gly−Gly−Phe−Gly四肽连接子最早在DOX与羧甲基普鲁兰结合物中被发现,表现出优于无连接子的偶联物的抗肿瘤效果。后续研究证明,该四肽连接子的药物释放依赖于肿瘤中cathepsin的表达。新型ADC DS-8201a (T-Dxd, trastuzumab deruxtecan),采用此类连接子,对高或低HER2表达的T-DM1耐药乳腺癌患者均有效。另一种TROP2靶向ADC Datroway (datopotamab deruxtecan) 也含有该四肽连接子,已被批准用于治疗不可切除或转移性乳腺癌患者。这些结果表明,三肽或四肽连接子是一种提升ADC稳定性与安全性的有效策略。
图3 | ADC连接子的化学结构与特征。 不可切割连接子主要包括MCC(马来酰亚甲基环己烷-1-羧酸酯)和MC(马来酰己酰)硫醚连接子。可切割连接子则可被酸性环境(如内体与溶酶体)、还原性分子(如谷胱甘肽)或酶切割。
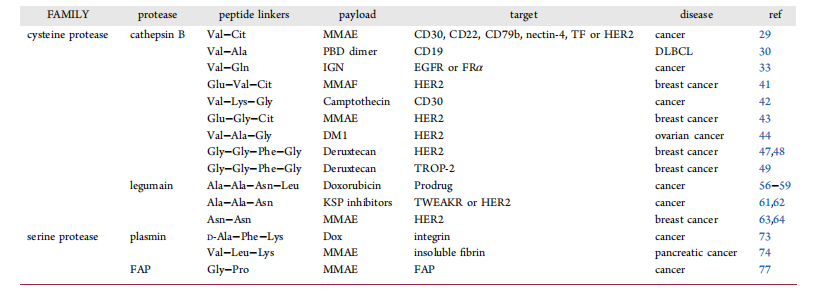
表2 | 含肽连接子的酶激活型ADC
目前多数已上市ADC采用cathepsin可切割肽连接子。然而,研究发现这些连接子也可能被外源酶(如Ces1C和中性粒细胞弹性蛋白酶)切割,从而导致脱靶毒性。人类基因组中已鉴定出600余种蛋白酶,其中许多与肿瘤增殖、侵袭和转移密切相关。因此,研究者开发了基于其他酶类(如legumain、纤溶酶PLM和成纤维细胞活化蛋白FAP)的肽连接子,以减少非特异性药物释放(表 2)。
2 Val−Cit与Val−Ala二肽连接子的缺陷
3 新型可被Cathepsin切割的肽连接子
4 利用其他酶切型肽连接子
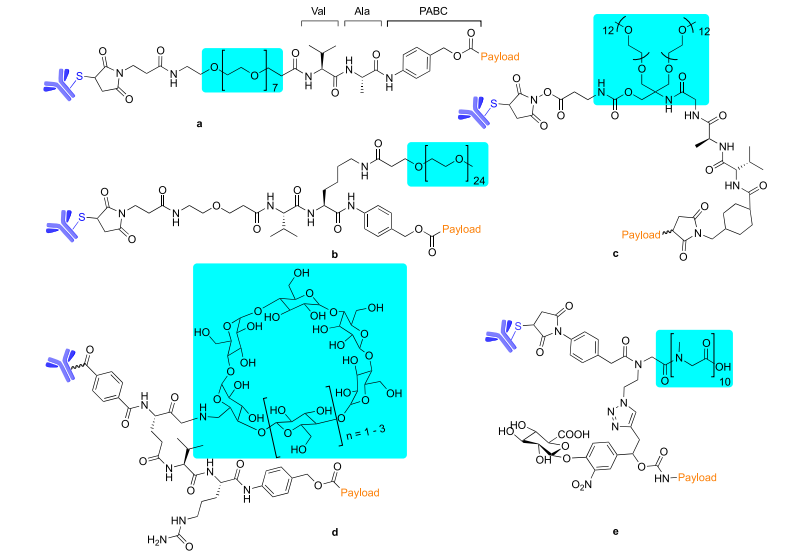
图4 | 代表性ADC连接子的化学结构 ,含有亲水性基团的修饰:PEG(a−c)、环糊精(d)与pSAR(e),青色背景部分为高亮。
参考文献:doi.org/10.1021/acs.jmedchem.5c01500