一旦筛选出针对目标的肽,就可以用不同成像模式的成像单元对其进行标记以提供成像信号。常见的标记单元包括放射性同位素、近红外荧光团等。根据标记单元的不同,可以为不同的成像模式使用不同的成像试剂,例如磁共振成像和荧光成像等。然而,每种成像模式都有其自身的优缺点;在设计成像试剂时,需要根据希望收集的生物信息类型选择最佳的成像模式。
1. 放射性核素成像
尽管多种成像方式正在迅速发展,但放射性核素成像仍是临床患者的首选。这主要是因为使用少量放射性成像剂即可实现高灵敏度的组织成像。单光子发射计算机断层扫描(SPECT)和正电子发射断层扫描(PET)构成了放射性核素成像。其中,SPECT具有伽马成像的优势,SPECT中常用的放射性同位素有锝-99m[99mTc]、碘-123[123I]和铟-111[111In]等。PET是另一种非常灵敏的分子成像方式,其成像剂通常用富含质子的放射性核素进行放射性标记,这些核素在衰变过程中会释放出正电荷(β+)。PET的物理原理允许在成像示踪剂中使用更多的放射性核素,例如碳-11[11C]、氮-13[13N]、氟-18[18F]、镓-68[68Ga]、铜-64[64Cu]和锆-89[89Zr]等。此外,要将上述放射性核素引入靶向肽中,必须先将其与配体螯合。主要有四种策略:挂坠式标记、整合式标记、辅基团掺入或直接标记(图6a)。通常,放射性核素的一部分可通过1,4,7,10-四氮杂环癸烷-1,4,7,10-四乙酸(DOTA)、2,2',2"-(1,4,7-三氮杂环壬烷-1,4,7-三基)三乙酸(NOTA)等直接螯合到肽上。
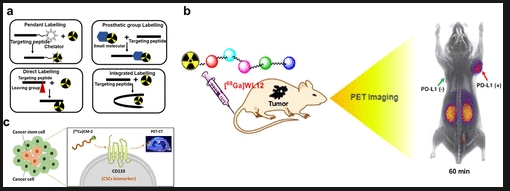
图 6. (a)将放射性同位素引入肽序列的各种方法。(b)[68Ga]WL12 可与正电子发射断层扫描(PET)结合使用,以区分 PD-L1 阳性肿瘤并量化肿瘤中的 PD-L1 表达。(c)[64Cu]CM-2 被设计为用于检测肿瘤中 CD133 癌干细胞群的 PET 放射性示踪剂。
目前,多种靶向肽已被用于正电子发射断层扫描/单光子发射计算机断层扫描(PET/SPECT)成像,例如,能特异性结合肿瘤细胞表面整合素(αvβ3)的RGD序列及其类似物(环状RGD类似物、RGD多聚体等)。[18F]FRGD2和[18F]FPPRGD2已通过临床试验审批。Nimmagadda等人将对PD-L1具有高亲和力的靶向肽W12(IC50≈23nM)与68Ga结合,制备了成像剂[68Ga]WL12。该成像剂可通过PET无创定量肿瘤中PD-L1的表达(图6b)。奥曲肽类似物是另一种在放射性核素成像中广泛使用的肽,对生长抑素受体(SSTrs)具有高亲和力。除此之外,我们团队开发了一种临床相关、稳定且基于靶向肽的正电子发射断层扫描(PET)示踪剂[64Cu]CM-2,用于多种癌症中CD133蛋白的定位。该示踪剂在多个临床前肿瘤模型中表现出对CD133阳性癌症干细胞的特异性结合,并显示出持久的肿瘤滞留和快速的肾清除(图6c)。
2. 荧光成像
荧光成像(FL)是一种无创的成像方式,具有高灵敏度、无辐射、无害以及操作简便等特点。然而,生物组织的自发荧光干扰以及光穿透深度有限限制了荧光成像在临床上的应用。近红外(NIR,650-1700纳米)由于其自发荧光低、组织穿透深、光散射小等特点,能够提供高分辨率以及信噪比,并已被证明是一种有效的实时成像方法。值得注意的是,与近红外I区(650-950纳米)相比,近红外II区(950-1700纳米)在邻近组织中的光子散射更低,空间分辨率更高。这些优势使得近红外IIa区(1300-1400纳米)/IIb区(1500-1700纳米)成像能够满足高分辨率和深组织成像的要求。
为了满足各种环境下的成像需求,人们开发出了多种具有不同特性的高灵敏度荧光团,从小分子到纳米粒子都有。其中,小分子荧光团具有明确的分子结构、高纯度和良好的重现性。近红外一区(NIR-I)常见的荧光团包括多甲川花青、酞菁、卟啉衍生物、方酸衍生物等。最具代表性的近红外一区荧光团是吲哚菁绿(ICG),它是美国食品药品监督管理局(FDA)批准用于临床近红外成像的唯一近红外荧光团。然而,其在水溶液中的量子产率仅为 0.01。而且,它存在血液循环时间短、血清稳定性差、肝脏摄取率高以及非靶向性等问题。此外,人们还合成了各种具有近红外发光特性的纳米粒子用于成像,包括量子点(QDs)、稀土纳米粒子、金纳米粒子等。与小分子相比,纳米粒子具有更高的稳定性、更长的血液循环时间等优点。然而,它们也存在设计复杂、难以大规模生产以及体内长期毒性未知等局限性。
通过将特定靶向肽与上述荧光团相结合,与增强渗透和滞留(EPR)效应相比,成像试剂能够更精准地递送至感兴趣的部位。通常,小分子荧光团可通过共价键直接与靶向肽相连。我们开发了一种针对肿瘤干细胞标志物CD133的肽CP(KD≈7×10-9M),并基于点击化学反应将其与近红外有机荧光团连接,制备了CP-IRT。CP-IRT具有约300纳米的斯托克斯位移,肿瘤与正常组织的信号比(T/NT)大于8。重要的是,其在肾脏中的排泄迅速(约6小时内排泄87%),我们首次实现了对完整小鼠组织中泌尿系统的无创荧光成像(图7a)。顾等人合成了对表皮生长因子受体(EGFR)具有高亲和力的靶向肽H1,并进一步将其与近红外荧光分子MPA偶联,合成了探针H1-MPA,该探针具有高肿瘤摄取率和信噪比,可用于定位肿瘤边界(图7b)。此外,我们设计并合成了对胶质瘤标志物CD133具有高亲和力的环肽NSCCP2,该肽与荧光团Nz相连,能够穿透血脑屏障(BBB)用于胶质瘤的原位成像。对于纳米粒子类荧光团,通过在其表面修饰靶向肽或抗体也能实现靶向递送,但这种策略需要复杂的合成方案,往往难以预测和控制。在此背景下,我们尝试利用非共价键实现纳米粒子荧光团的有效递送。我们设计了一个类似表面活性剂的肽库,并成功筛选出对免疫检查点CD47具有高亲和力的肽RT(KD≈3.18×10-7M)。该肽能够自组装成纳米纤维,并能依靠非共价键相互作用在其自组装过程中有效捕获Ag2S量子点。体内成像结果表明,这种成像试剂能有效富集于肿瘤组织,并能长时间保持稳定。
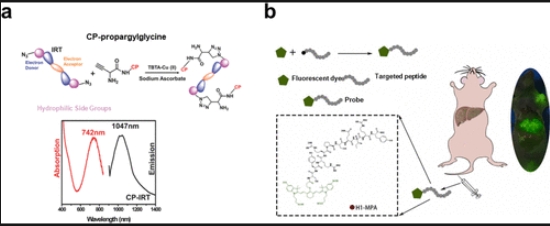
图 7. (a)靶向 CD133 的近红外二区染料 - 肽探针 CP-IRT 的结构和光谱。。 (b)H1-MPA 的结构,这是一种靶向 EGFR 肽的近红外探针。
3. 磁共振成像
磁共振成像(MRI)在临床诊断中得到了广泛应用。MRI是一种非侵入性技术,具有极高的空间分辨率和无辐射暴露的优点。这一特性使得即使只有几百个细胞大小、几百微米的肿瘤也能被早期检测出来。然而,MRI的灵敏度较低,通常需要使用造影剂来提高其灵敏度。一般来说,MRI造影剂大致可分为纵向弛豫造影剂(T1准备)和横向弛豫造影剂(T2准备)。T1造影剂具有高信号强度和相对明亮的T1加权图像,可用于解剖学。相比之下,T2造影剂的T2加权图像较暗,信号强度较低,有利于病变观察。顺磁性材料,包括超顺磁性氧化铁纳米颗粒等,常被用作造影剂,以增加感兴趣组织中水质子的T1和T2弛豫率,并产生对比增强效果,用于诊断成像。Sugahara等人通过将环肽IRGD(CRGDK/RGPDC)整合到磁性纳米虫上构建了靶向磁共振成像(MRI)造影剂。静脉注射后,整合素和神经纤毛蛋白表达肿瘤的T2加权MRI信号显著降低,肿瘤局部荧光增强(图8a)。此外,Lu等人通过将靶向肽ZD2与羟基化的Gd3N@C80相连接合,合成了用于乳腺癌敏感分子磁共振成像的高度弛豫靶向造影剂ZD2-Gd3N@C80。这种造影剂具有出色的T1弛豫性能,约为传统钆基MRI造影剂的20倍。使用较低剂量造影剂的MRI在多个侵袭性三阴性乳腺癌(TNBC)肿瘤中产生强烈的信号增强,而在低风险乳腺肿瘤中的效果则不那么明显(图8b)。
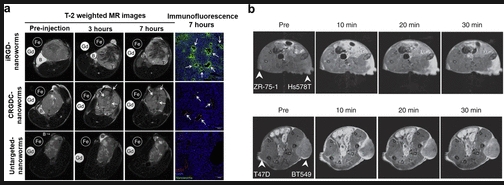
图8.(a)用iRGD包被的氧化铁纳米虫进行肿瘤成像。(b)用ZD2-Gd3N@C80对小鼠其他乳腺肿瘤进行分子磁共振成像。
4. 光声成像
光声成像(PAI)基于物体因吸收光而产生热膨胀的原理。作为一种新兴的成像技术,PAI有潜力增强超声波并丰富光学对比度。PAI的优势在于具有高空间/时间分辨率的潜力以及不存在电离辐射等。目前,基于近红外特性的多种PAI探针已被开发出来,例如吲哚菁绿(ICG)、卟啉等。刘等人通过将光敏剂卟啉(PpIX)与功能肽单元偶联,并进一步通过自组装构建了一种一体化自递送纳米系统。在光声成像引导下,单次静脉注射后,联合化疗-光热治疗的体内肿瘤抑制率高达70%,这使得化疗剂量显著减少(图9a)。叶等人报道了一种基于生物相容性响应介导自组装策略的可激活半胱氨酸天冬氨酸蛋白酶3(caspase-3)PA成像探针(1-RGD),该探针通过整合肿瘤靶向配体(即c-RGD)和PA成像染料实现。1-RGD能够被凋亡肿瘤组织中的活性半胱天冬酶-3有效激活,从而产生强烈的光声信号以检测半胱天冬酶-3的活性。利用重建的三维光声图像,1-RGD能够准确报告肿瘤组织中半胱天冬酶-3激活的位置,有望用于早期监测肿瘤对化疗的凋亡反应(图9b),这可能对无创癌症成像和监测有用。
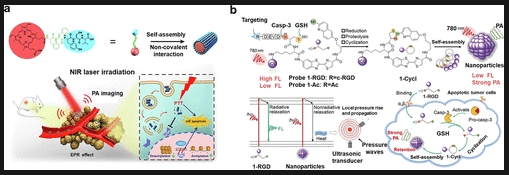
图9.(a)PpIX-FFYSV分子结构示意图以及单体自组装成纳米棒状纳米聚集体(PpIXNAs)用于体内肿瘤光声成像的示意图。(b)1-RGD的化学结构以及1-RGD用于检测凋亡肿瘤细胞中半胱氨酸天冬氨酸蛋白酶-3活性的光声成像机制示意图。
5. 多模态成像
上述提到的各种单一模式成像方式已在多种生物医学应用中得到部署,并能为疾病诊断提供参考。然而,各种成像方式都存在固有的缺陷,例如荧光成像存在固有的穿透深度限制,正电子发射断层扫描成像空间分辨率低,而光声成像由于灵敏度低难以进行全身磁共振成像并获取定量图像。多模态成像,即成像方式的组合,能够克服独立技术的局限性,有可能产生全面的解剖和/或分子信息,从而改善体内成像。在过去的几年里,关于多模态造影剂开发的研究呈爆炸式增长。叶等人利用共组装和氧化还原介导的解组装策略开发了一种针对胶质瘤的氧化还原响应共组装纳米颗粒(CoNP-RGD1/1)。Co-NP-RGD1/1能够穿过血脑屏障,并在靶向肽RGD存在的情况下在αvβ3阳性的胶质瘤中聚集,从而在原位U87MG肿瘤中产生明亮的磁共振对比度(>53%SE)和增强的近红外荧光信号,从而能够无创且精确地定位小鼠大脑中的肿瘤位置。此外,通过荧光和磁共振双模态成像结果(图10a)表明,Co-NP-RGD1/1与化疗-PDT联合使用可抑制皮下和原位U87MG胶质瘤的进展,并显著延长小鼠的中位生存期。此外,通过自组装和氧化还原驱动分解策略,该团队还报道了一种肿瘤靶向、氧化还原响应的磁性和荧光光敏剂纳米组装体(NP-RGD),可用于在近红外/磁共振双模态成像引导下对肿瘤进行局部放射治疗。它能够通过αvβ3有效进入肿瘤细胞,产生明亮的磁共振对比度,实现肿瘤位置的高分辨率成像。在肿瘤细胞内,其分解为荧光小分子产物和疏水性有机PS不仅开启了其近红外荧光,还延长了其在肿瘤细胞内的滞留时间,从而改善了肿瘤的光动力治疗(图10b)。实际上,尽管多模态成像克服了单模态成像的一些局限性,但并非所有应用都需要这种策略。此外,值得注意的是,简单地将所有功能添加到单个分子中可能并不实际,因为不同成像模式的灵敏度可能差异很大。最后,多模态成像试剂的临床实用性仍有待确定,而且绝大多数研究似乎并未涉及临床患者来表征探针的临床相关能力。
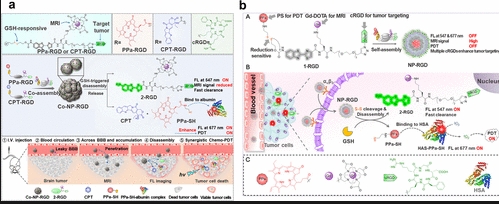
图10.(a)共组装纳米粒子CoNP-RGD1/1的设计原理及其产生磁共振和近红外荧光信号过程的示意图。(b)构建近红外/磁共振双模态成像纳米探针NP-RGD以及其在肿瘤细胞中成像和产生光动力治疗效应的原理。
参考文献:doi.org/10.1021/cbmi.3c00104