肿瘤转移是癌症治疗中的重大挑战,通常与患者高死亡率相关。目前普遍认为肿瘤侵袭和转移与细胞外基质(ECM)的降解有关。受天然细胞外基质形成过程以及本研究小组开发的原位自组装策略的启发,本文原位构建了一种基于可转换层粘连蛋白(LN)模拟肽1(BP-KLVFFK-GGDGR-YIGSR)的人工细胞外基质(AECM),用于抑制肿瘤侵袭和转移。肽1由三个模块组成:(i)疏水性双芘(BP)单元,用于形成和追踪纳米颗粒;(ii)KLVFF肽基序,倾向于通过分子间氢键形成和稳定纤维结构;(iii)源自LN保守序列的Y型RGD-YIGSR基序,作为配体与癌细胞表面结合。由于BP的强疏水作用,肽1通过快速沉淀法形成纳米颗粒(1-NPs)。静脉注射后,由于增强的渗透性和滞留(EPR)效应以及RGD-YIGSR的靶向能力,1-NPs能够有效地在肿瘤部位聚集。聚集的1-NPs在实体瘤周围同时转化为纳米纤维(1-NFs),并进一步缠绕形成AECM,与肿瘤细胞表面的受体结合。AECM在原发肿瘤部位稳定存在超过72小时,从而有效抑制了乳腺癌和黑色素瘤模型中的肺转移。两种肿瘤模型的抑制率分别为82.3%和50.0%。这种体内自组装策略可广泛用于设计有效的无药物生物材料,以抑制肿瘤侵袭和转移。
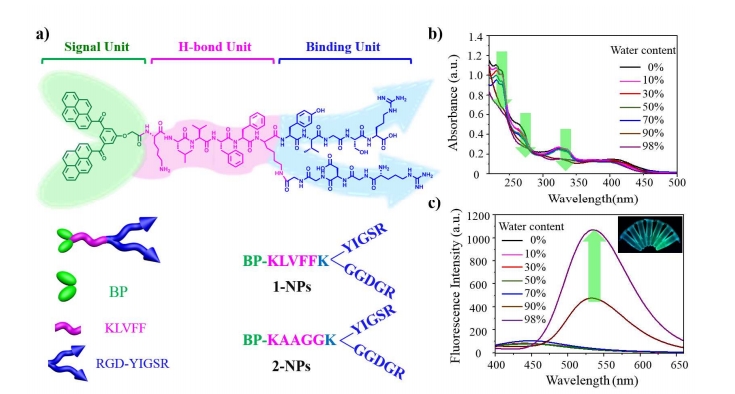
为了进行比较,通过突变自组装基序合成了不可转化的对照肽2(BP-KAAGGK-GGDGR-YIGSR)。
总之,文章开发了一种仿生策略来构建用于抑制肿瘤侵袭和转移的仿生细胞外基质(AECM)。设计的模拟层粘连蛋白肽构建单元1自组装成1-NPs,通过静脉注射经由被动和主动积累机制递送至肿瘤部位。聚集的1-NPs通过配体-受体结合的仿生组装策略转变为1-NFs网络作为AECM。AECM作为长期屏障,与天然细胞外基质竞争结合位点,从而高效抑制肿瘤转移和肿瘤生长。因此,这种原位仿生构建AECM的方法在抑制肿瘤侵袭和转移方面显示出巨大潜力。
参考文献:DOI:10.1021/acsnano.7b00781